
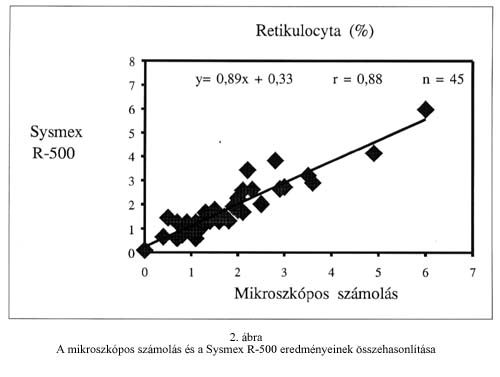
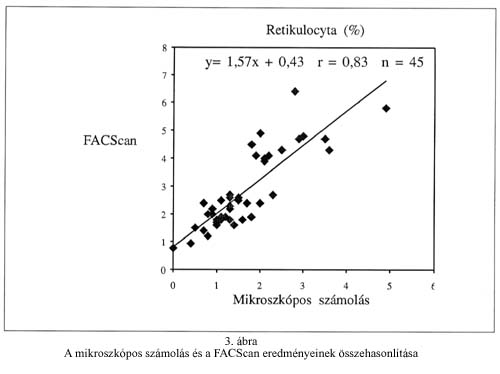
The reticulocyte count is an important indicator of the erythropoietic activity of the bone marrow. The purpose of this study was to compare a new automated reticulocyte analyser (Sysmex R-500) to the manual method using brillant-cresyl blue and to a flow cytometric method using thiazole orange (TO). The results obtained by Sysmex R-500 correlated well with the microscopic data (r=0.88, y=0.89x+0.33). The FACScan analyser using TO showed higher values when compared to both the manual method and Sysmex R-500. This difference was the most significant in case of blood samples with an elevated leucocyte count. Based on measurements of 50 normal samples the reference interval was 0.4-1.7% (19-77 x 109/L) for Sysmex R-500 and the reticulocyte analysis was not influenced by leucocytes.
Key words: reticulocyte, flow cytometry, thiazole orange, polymethine dye, leucocyte interference
A retikulocyta szám a csontvelő erythropoietikus aktivitását jellemzi. Meghatározására szükség van az anémiák differenciál diagnosztikájában és kezelésük hatékonyságának követésében, a csontvelő transzplantációt és kemoterápiát követő regeneráció, valamint az erythropoietin kezelés hatásosságának monitorozásában (1). A retikulocyta számot hagyományosan brillantkrezilkék vagy új metilénkék festés után fénymikroszkópos számolással határozhatjuk meg (2,3). Ez a módszer azonban időigényes és pontatlan. Az automatizált metodikák, mint az áramlási citométerek, számos előnnyel rendelkeznek: egy nagyságrenddel nagyobb a vizsgált sejtek száma, gyorsabb, jobb az eredmények reprodukálhatósága, kisebb a statisztikai hibalehetőség (4,5).
A retikulocyták jelölésére különböző fluoreszcens festékek alkalmasak, pl. auramin-O, tiazol narancs (TO), melynek molekulái 488 nm hullámhosszú lézerfénnyel gerjeszhetők (6,7). A Sysmex R-500 automata retikulocyta számláló analizátor egy polymethin elnevezésu fluoreszcens festéket alkalmaz, amely ugyancsak a retikulocytákban levő reziduális nukleinsavakhoz kötődik, de a gerjesztő fény hullámhossza 633 nm.
A vizsgálataink célja az volt hogy összehasonlítsuk a három módszert (mikroszkópos számolás, áramlási citometria, Sysmex R-500-al végzett analízis), megállapítsuk az R-500-al végzett retikulocyta analízis referencia tartományát, valamint megvizsgáljuk az emelkedett leukocyta szám esetleges interferáló hatását.
A retikulocyta meghatározást a laboratóriumba rutin vizsgálatra küldött 86 db perifériás vérmintán végeztük. A K3EDTA-val alvadásgátolt vérminták 24 órán belül feldolgozásra kerültek, tárolásuk 4oC-on történt.
Mikroszkópos számoláshoz a sejteket brillantkrezilkék (REANAL Rt.) festékkel festettük. 50 µL festékoldatot és 50 µL teljes vért inkubáltunk szobahőn 60 percig. Ezt követően kenetet húztunk és minden esetben 2000 vörösvérsejtet számoltunk meg.
Az áramlási citométerrel történő mérés előtt a mintákat tiazol naranccsal jelöltük. Ehhez a Becton Dickinson cég Retic-COUNTTM reagensét használtuk, 2,5 µL teljes vért festettünk meg 500 µL reagenssel. A mérést 60 perc inkubációt követően a FACScan (Becton Dickinson) áramlási citométerrel végeztük, 10000 sejt adatait analizáltuk Retic-COUNT software-vel. Kontrollként a Retic-Chex (Streck Laboratories, Omaha, NE) teljes vért használtuk.
A Sysmex R-500 analizátor ugyancsak áramlási citometria elvén működik. A hidrodinamikus fókuszálás segítségével és a fényszórási tulajdonságok alapján azonosítja és számolja a sejteket. A mérés mintaelőkészítést nem igényel, mivel a RET-SEARCH(II) festékoldatban levő polymethin fluoreszcens festéket az analizátor adagolja a primer csőből felszívott, majd higított teljes vérmintához. A felszívott minta mennyisége 50 µL, amihez a diluenssel történő higítás után 20 µL polymethin festéket ad a készülék, ezt követően 30000 vörösvérsejtet vizsgál meg. A reakciókamrából 41oC-on zajló inkubáció után a sejtek az áramlási cellában egyenként elhaladnak a 633 nm hullámhosszú lézerfény előtt. A készülék a fényszórás és a sejtek fluoreszcenciás jele alapján határozza meg a retikulocyta arányt (%), az abszolút retikulocyta számot (106/µL) és a vörösvérsejt számot (106/µL). Óránként kb. 40 minta analizálására van lehetőség. Minőségi kontrollként a Ret-Check II (Sysmex-TOA Medical Electronics Company) teljes vér kontrollt használtuk.
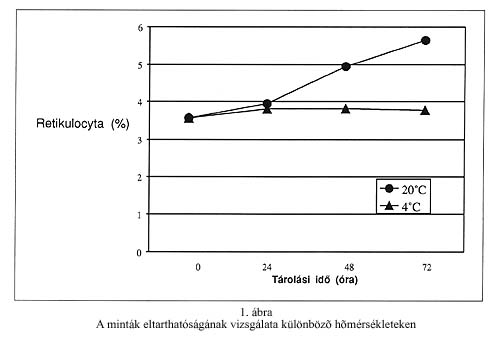
A Sysmex R-500 analizátoron mért három különböző retikulocyta számú minta esetén vizsgáltuk a reprodukálhatóságot (within-run precision). A variációs koefficiens (CV) értékeket az 1. táblázat mutatja. (Az abszolút reticulocyta számot a nemzetközi gyakorlatnak megfelelően 109/L egységben tüntettük fel.) A rutinhiba variációs koefficiensét a Ret-Check II kontroll tíz egymást követő napon történt mérésével határoztuk meg, gyári érték: 3,11% (x=3,02%, SD=0,194, CV=6,45%). A festetlen vérminták eltarthatóságát két különböző hőfokon (4oC, 20 oC) három egymás utáni napon vizsgáltuk. (1. ábra) A torzítás vizsgálathoz a Ret-Check II (Sysmex R-500 kontroll) és a Retic-Chex (FACScan kontroll) teljes vér kontrollok százalékos retikulocyta értékeit használtuk. (2. táblázat). A mikroszkópos számolással kapott eredmények jó korrelációt mutattak a Sysmex R-500 analizátoron mért eredményekkel. (2. ábra). A FACScan áramlási citométerrel viszont jelentős fölémérést tapasztaltunk mind a mikroszkópos, mind a Sysmex R-500 analizátorhoz képest (3. és 4. ábra).



Mivel a Sysmex R-500 készülékkel a tiazol narancsos metodikához képest alacsonyabb értékeket kaptunk, 50 hematológiai szempontból normál minta segítségével meghatároztuk a módszer referencia tartományát mely 0,4-1,7%-nak illetve 19-77x109/L abszolút retikulocyta számnak adódott. Leukémiás betegek mintáiban (n=20), ahol a leukocytaszám meghaladta az 50x109/L értéket, a fehérvérsejtek interferáló hatását észleltük az áramlási citometriás retikulocyta meghatározás során. (5. ábra)

Az automatizált retikulocyta meghatározási módszerekkel sokkal gyorsabban, legalább egy nagyságrenddel több sejtet analizálhatunk, mint a hagyományos mikroszkópos számolás során. Az áramlási citometria elvén alapuló módszerek közül a Sysmex R-500 retikulocyta automatával a normál és a patológiás tartományban is jól reprodukálható értékeket kaptunk. A retikulocyta szám növekedésével a variációs koefficiens értékek csökkentek. Az eredmények jó egyezést mutattak a manuális meghatározással (r=0,88), de a FACScan eredményeit összehasonlítva a Sysmex R-500 adataival és a mikroszkópos számolással fölémérést tapasztaltunk, ami emelkedett fehérvérsejtszám esetén még jelentősebb volt.
Korábban az intézetünkben végzett összehasonlító vizsgálatok során jól megegyező értékeket mértek a mikroszkópos és a TO-t használó áramlási citometriás módszerrel (8). Ezek a mérések azonban Coulter Epics Profile II áramlási citométeren történtek és az akkor megállapított referenciatartomány 0,5-1,7% volt. Az időközben történt készülékváltás során (BD, FACScan) azonban ugyanazon módszert alkalmazva is eltérő értékeket kaptunk. Ekkor új referencia tartomány megállapítására került sor, amelynek alapján az érték 0,5-2,5%-ra módosult. A fentiek aláhúzzák annak jelentőségét, hogy retikulocyta meghatározás során még ugyanazon metodika használata mellett is eltérő értékeket kaphatunk különböző típusú készülékekkel. Ezt a jelenséget thrombocyta P-selectin felszíni analízise során is megfigyelték, ahol hasonlóan az általunk észlelthez a BD FACScan készülékkel jelentősen magasabb értékeket mértek, mint egy Coulter típusú citométeren (9). A jelenleg az R-500-ra megállapított 0,4-1,7%-ig tartó referencia tartomány gyakorlatilag megegyezik az első áramlási citometriai módszer valamint a mikroszkópos számolás referencia tartományával, így a manuális metodika és az R-500-zal mért eredmények egyezése érthető. Fontos annak hangsúlyozása, hogy a nemzetközi irodalom alapján a retikulocyta százalék mellett az abszolút retikulocyta szám megadása is feltétlenül szükséges. Az általunk kapott eredmények hasonlóak az irodalomban található, Sysmex R sorozathoz tartozó automata reticulocyta analizátorokra megállapított százalékos és abszolút referencia tartomány értékeihez (6,10-12).
A leukémiás betegek mintáiban, ahol a leukocyta szám meghaladta az 50x109/L-t, a leukocyták bizonyos százalékát retikulocytaként azonosította a FACScan. A Sysmex R-500 automatánál nem tapasztaltunk fölémérést, a manuális módszerhez hasonló értékeket mértünk. Irodalmi adatok alapján a Sysmex R sorozathoz tartozó tartozó egyéb készüléknél is tapasztalható bizonyos mértékű interferencia, de ott auramin-O az alkalmazott fluoreszcens festék, míg az R-500-as automatánál a polymethin. Az eredményeink azt mutatják, hogy a fehérvérsejtek interferáló hatása itt nem érvényesül (13). A laboratóriumba érkezett festetlen vérminták tárolása során a retikulocyta számban számottevő változást nem láttunk, amennyiben a tárolás hűtve történt. Ajánlatos tehát a mintákat 4oC-on tartani, így akár 72 óráig is tárolhatók.
A Sysmex R-500-as automatával óránként 40 vérmintát mérhetünk le, a mérés minta előkészítést nem igényel. Vizsgálataink alapján a készülék gyors, pontos és megbízható eredményeket ad, valamint a fehérvérsejtek interferáló hatásával sem kell számolnunk.
Davies SV, Cavill I, Bentley N, et al.: Evaluation of erythropoiesis after bone marrow transplantation: quantitative reticulocyte counting Br. J. Haemat. 1992; 81(1): 12-17.
Rodak BF et al.: Diagnostic Hematology. Philadelphia, Pennsylvania: W.B. Saunders Company, 1995; 138-141.
Bain BJ: .Blood Cells A Practical Guide. London: Gower Medical Publishing, 2nd ed, 1989; 24-27, 37-40.
Ferguson DJ, Siow-Fong Lee, Gondon PA.: Evaluation of reticulocyte counts by flow cytometry in a routine laboratory Am. J. Haemat. 1990; 33: 13-17.
Kazuhide K, Masumi N, Kazue S, et al.:. An automated optoelectronic reticulocyte counter Am. J. Clin. Pathol. 1989; 92: No. 1: 57-61.
Bowen D, Bentley N, Hoy T, et al.: Comparison of modified thiazole orange technique with a fully automated analyser for reticulocyte counting J. Clin. Pathol. 1991; 44: 130-133.
Lee LG, Chia-Huei C, Chin LA. Thiazole Orange: A new dye for reticulocyte analysis Cytometry 1986; 7: 508-517.
Závodszky M, Muszbek L. Retikulocytaszám meghatározás Coulter Epics Profile II flow cytométerrel. Laboratóriumi Diagnosztika 1993; 22: 13-17
Serebruany VL, Kereiakes DJ, Dalesandro MR, et al.:. The Flow Cytometer Model Markedly Affects Measurement of ex vivo Whole Blood Platelet-Bound P-Selectin Expression in Patients with Chest Pain: Are We Comparing Apples with Oranges? Thromb. Res. 1999; 96: 51-56
Kraaijenhagen RJ. Reticulocyte reference values by the Bhattacharya method: results of a pilot study. Clin Lab Haemat. 1996; 18(1): 15-16
Tarallo P, Humbert J-C, Fournier B, Mahassen P, Henny J. Reticulocytes: reference limits. Clin Lab Haemat. 1996; 18(1): 13-14
Tarallo P, Humbert JC, Mahassen P, et al.: Reticulocytes: biological variations and reference limits. Eur J Haematol. 1994; 53(1): 11-15
Villamor N., Kirsch A., Huhn D., et al.: Interference of blood leucocytes in the measurements of immature red cells(reticulocytes) by two different (semi-) automated flow-cytometry technologies. Clin Lab Haemat. 1996; 18: 89-94
* Levélcím: dr. Simon Ágnes
Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Klinikai Biokémiai és
Molekuláris Patológiai Intézet
H-4012 Debrecen Pf. 40. E-mail:asimon@jaguar.dote.hu
Fax: 52-417-631, Tel:52-431-956