The aim of this study was to clarify the possible influence of the different methods used for determining the Sumetrolim susceptibility of a set of strains belonging to the family Enterobacteriaceae. The resistance to Sumetrolim of 100 strains was examined on Mueller-Hinton (MH) agar plates prescribed by the HUMAN Ltd in the Resistest brochure, parallel with on the MH agar plates (bioMérieux) recommended by the NCCLS. The results of disc diffusion method (HUMAN and OXOID discs) were compared with the results measured by Etest on both media. There was no significant difference between the results obtained with HUMAN and OXOID discs, and Etest. In contrast with that, on bioMérieux Mueller-Hinton agar 77%, on the agar prescribed by the HUMAN agar 70% of the strains showed sensitivity. Results of the sensitivity test to Sumetrolim considerably depends on the composition and quality of the media used.
Key words: sulfamethoxazole/trimethoprim, Entero-
bacteriaceae, susceptibility,
A szerzők megvizsgálták, hogy az Enterobacteriaceae családba tartozó baktériumok Sumetrolim érzékenységének eredményét hogyan befolyásolják a meghatározásra alkalmazott különböző módszerek. Klinikai mintákból frissen izolált 100 baktériumtörzs Sumetrolim érzékenységét vizsgálták párhuzamosan a HUMAN Rt. által a Resistest használati utasításban leírt, valamint az NCCLS által ajánlott (pl. bioMérieux) Mueller-Hinton táptalajokon. A korongdiffúziós módszer eredményeit (HUMAN és OXOID korongok) összehasonlították a minimális gátló koncentrációs értékekkel (Etest). A HUMAN és OXOID korongokkal, valamint az Etesttel mért eredmények között nem volt szignifikáns az eltérés. Viszont a bioMérieux Mueller-Hinton agaron a törzsek 77%-a bizonyult érzékenynek, míg a HUMAN Rt. által leírt agaron csak 70%-a. Az eredményekből kitűnik, hogy a baktériumok Sumetrolim iránti érzékenységének meghatározását befolyásolja az alkalmazott táptalajok minősége, összetétele.
Kulcsszavak: sulfamethoxazol/trimethoprim, Entero-
bacteriacea, érzékenység
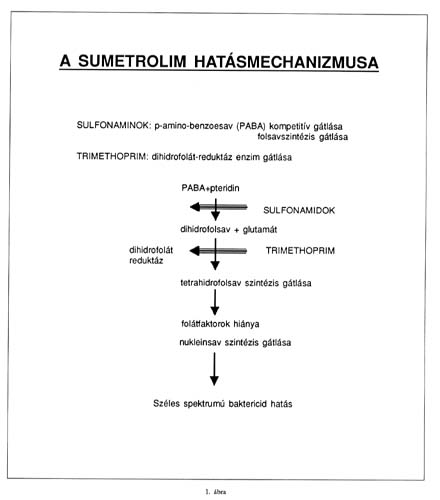
A SUMETROLIM HATÁSMECHANIZMUSA

A Sumetrolim (EGIS Gyógyszergyár Rt.) a sulfamethoxazol és a trimethoprim 5:1 arányú kombinációja. A sulfamethoxazol a sulfonamidok csoportjába tartozó antibiotikum, alapvegyülete a para-amino-benzo-szulfonsav. Ez volt az első antibakteriális kemoterápiás szernek, a Prontosilnak a hatóanyaga (1932, Domagk). A sulfonamidok a para-amino-benzoesav (PABA) kompetitív antagonistái, belépnek a PABA helyére a pteridinnel való kapcsolódásnál, és megakadályozzák a dihidro-pteroinsav kialakulását (1. ábra). A PABA leszorításával gátolják a dihidrofolsav kialakulását azokban a baktériumokban, melyek maguk szintetizálják a folsavat, mert nem képesek készen felvenni azt a környezetükből. A folsav nélkülözhetetlen a purin és pirimidin bioszintéziséhez. Ilyen módon a sulfonamidok a folsavszintézis gátlásával bakteriosztatikus hatásúak az érzékeny baktériumokra.
A trimethoprim a folsav szintézis következő lépésében a dihidrofolsav-reduktáz enzim hatását gátolja, így megakadályozza a dihidrofolsav tetrahidrofolsavvá történő átalakítását, amely a purin és végső soron a DNS szintézishez vezetne. A sulfonamidok és a trimethoprim tehát a baktérium folsav szintézisének két különböző lépését gátolja, egymás hatását szinergista módon erősítve. Ennek eredményeként a baktérium nem képes szintetizálni a nukleinsav felépítéséhez nélkülözhetetlen purin és pirimidin bázisokat. A két összetevő szinergista hatásának köszönhetően a kombinációval baktericid hatású antibiotikumot kapunk, mely szélesebb spektrumú, nagyobb terápiás indikációval rendelkező szer, mint a két komponens külön-külön alkalmazva. (1,2,3,4,5,6)

A sumetrolim hatását gátló anyagok
A környezetben, tehát az érzékenység meghatározásra használt táptalajban is jelen lehetnek bizonyos anyagok, melyek a Sumetrolim hatását gátolják. A sulfonamidok bakteriosztatikus hatását antagonizáló anyagok közül a PABA-nak tulajdonítják a legnagyobb jelentőséget. A hasonló szerkezeti felépítés miatt egymás kompetitív antagonistái. A sulfonamidok egyéb inhibitorai, mint a metionin, és egyes purin- illetve pirimidin származékok nem kompetitív módon függesztik fel a szulfonamid hatását.(4,7)
A trimethoprim hatását is gátolhatják bizonyos aminosavak, ribonukleozidok, más szerves vegyületek. A legfontosabb közülük a timidin, melynek gátló szerepét Koch és Burchall bizonyította be, miközben a folsav szintézis végtermékei között keresték a potenciális antagonistákat. Kimutatták, hogy in vitro csökken a trimethoprim aktivitása a táptalaj timidin koncentrációjának növekedésével, mivel a baktérium a készen kapott timidin felhasználásával elkerüli a szintézis azon lépését ahol a trimethoprim gátló hatása érvényesülne. Az exogén timidin hasznosítására képes baktérium speciesek szaporodását így a Sumetrolim nem gátolja timidin jelenlétében. A timidin mennyiségét a táptalajban egy kritikus érték alatt tartva ez a hatás megszűnik. (4,7,8,9)
A baktériumok Sumetrolim érzékenységének meghatározásánál tehát fontos, hogy olyan táptalajt használjunk, amelyben ezen gátló anyagok mennyisége minimális.

Az Enterobacteriaceae családba tartozó baktériumok Sumetrolim érzékenységének eredményét hogyan befolyásolják a meghatározásra alkalmazott különböző módszerek?

A vizsgálatainkhoz felhasznált, Enterobacteriaceae családba tartozó 100 baktériumtörzset a SOTE Mikrobiológiai Intézetébe érkezett klinikai vizsgálati anyagokból izoláltuk, majd frissen teszteltük. Identifikálásuk ATB-vel (ID 32 E, bioMérieux) történt. A vizsgálati anyag species szerinti megoszlását szemlélteti a 2. ábra. Az izolátumok különböző betegekből kerültek kitenyésztésre, s az érzékenység meghatározásnál az egy beteg egy izolátum elve érvényesült.

Mind a 100 baktériumtörzs esetén párhuzamosan, azonos inkubációs feltételek mellett vizsgáltuk a különböző módszereket. Minden törzs Sumetrolim érzékenységét teszteltük kétféle táptalajon, kétféle koronggal korongdiffúziós módszerrel, valamint a minimális gátló koncentráció meghatározásával. (10,11,12,13,14)
Vizsgálatainkhoz használtuk egyrészt a HUMAN Rt. által a Resistest használati utasításban leírt összetételű Müller-Hinton (MH) táptalajt, melyet az intézetünk táptalajkonyháján készítettek (ennek összetétele: 5 g/l beef extract, 17,5 g/l lactacid, 1,5 g/l keményítő, 13 g/l agar, pH 7,4). Az ezen kapott eredményeket összehasonlítottuk a National Committee for Clinical Laboratory Standards (NCCLS) által ajánlott, alacsony timin-timidin koncentrációjú Müller-Hinton táptalajon mért értékekkel. A bioMérieux által gyártott Mueller-Hinton 2 agart használtuk (ennek összetétele: 300 g/l beef infusion, 17,5 g/l bio-Case, 1,5 g/l starch, 17 g/l agar, pH 7,3).
A baktériumtörzsek Sumetrolim érzékenységét vizsgáltuk korongdiffúziós módszerrel egyrészt HUMAN Resistest Sumetrolim koronggal, melynek hatóanyag tartalma 25 µg Sumetrolim, másrészt OXOID sulfamethoxazol/trimethoprim koronggal, melynek hatóanyag tartalma 23,75 µg/1,25 µg az egyes összetevőkből. A minimális gátló koncentráció meghatározás a trimethoprim/sulphamethoxazole (1/19) Etesttel (AB BIODISK), a gyártók által leírt methodika szerint történt.
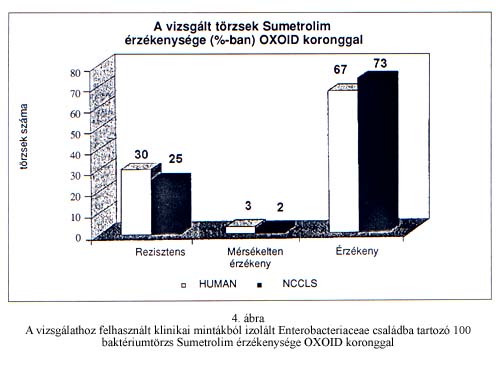
A korongdiffúziós módszerrel kapott átlagos gátlási zónaátmérőket mutatja az 1. táblázat a két különböző táptalajon a kétféle korong használatával. Látható, hogy az OXOID koronggal kapott átlagos gátlási zónaátmérők kisebbek, mint a HUMAN koronggal mértek. Ez szignifikáns eltérést jelent. Mivel mindkét korongban a leírás szerint 25 µg a Sumetrolim hatóanyag, a magyarázat a korongok papír-alapanyagában keresendő. A korongok tartalmazhatnak olyan festéket, vagy impregnáló anyagot, esetleg átnedvesedésük mértéke különböző, mely növeli vagy éppen csökkenti a hatóanyag diffúziójának sebességét a táptalajban. Egyébként ez a különbség az eredmények értékelésekor nem jelentkezik szignifikánsan, hiszen a gyártók által megadott interpretálási határértékek ezt figyelembe veszik. Ugyanis HUMAN korong esetében Sumetrolimra érzékenyek azok a baktériumok, melyeknél a gátlási zónaátmérő >=20 mm, mérsékelten érzékenyek 12 és 19 mm között, rezisztensek, ha az átmérő <=;11 mm. Az OXOID korongnál ezek az értékek a következőképpen alakulnak: érzékeny, ha >=16 mm, mérsékelten érzékeny 15 és 11 mm között, rezisztens, ha <=10 mm. A korongdiffúziós módszerrel kapott eredmények interpretálását mutatja a 3. és a 4. ábra. Látható, hogy mindkét koronggal több baktériumtörzs volt érzékeny a Sumetrolimra az NCCLS által ajánlott táptalajon (HUMAN koronggal 77%, OXOID koronggal 70%), mint a HUMAN leírása alapján készített agaron (HUMAN koronggal 70%, OXOID koronggal 67%).
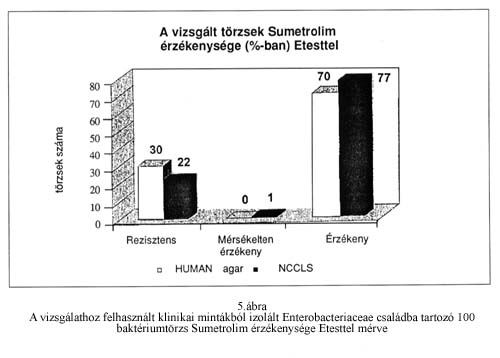
A minimális gátló koncentrációs értékeket láthatjuk a 2. táblázatban. Az E-testtel vizsgálva érzékenynek tekintettük Sumetrolimra azokat a baktériumokat, melyeknél a MIC érték <=2/38 µg/ml, rezisztensnek, ha a MIC érték >=4/76 µg/ml. Az így kapott eredményeket szemlélteti az 5. ábra. A bioMérieux MH agaron a törzsek 77%-a bizonyult érzékenynek, míg a HUMAN MH agaron 70%-a.
Az eredményekből kitűnik, hogy a klinikai mintából izolált Enterobacteriaceae családba tartozó 100 baktériumtörzs közül az NCCLS által ajánlott táptalajon több izolátum mutatkozott érzékenynek Sumetrolimra, mint a HUMAN által leírt összetételben készített táptalajon. A korongdiffúziós módszerrel (mindkét koronggal), valamint a minimális gátló koncentráció meghatározásával is hasonló adatokat kaptunk. Tehát mind a HUMAN, mind az OXOID korongok éppen olyan jó minőségűek. Mind a három módszerrel ugyanazon 7 baktériumtörzs esetében tapasztaltuk az érzékenységbeli különbségeket a kétféle táptalajon. A 7 izolátum közül 3 törzs Klebsiella pneumoniae, 3 db Escherichia coli, 1 db Enterobacter cloacae volt, különböző vizsgálati anyagokból. Az eltérés oka a táptalajban lévő inhibitorok jelenléte lehet. A Müller-Hinton táptalaj leginkább a kis PABA tartalma miatt alkalmas a sulfonamid típusú vegyületek iránti érzékenység vizsgálatára. Azonban további inhibitorokkal, főleg a timidinnel is számolni kell. A korrekt Sumetrolim érzékenység meghatározáshoz tehát olyan táptalajra van szükség, mely csak minimális mennyiségben tartalmaz timidint is. Az igényesebb baktériumok esetében, melyeknél a táptalajhoz vér hozzáadása is szükséges, még problémásabb a helyzet. A valódi megoldás az lenne, ha az érzékenységi vizsgálatokhoz használt táptalaj az antagonista anyagokat csak fiziológiás mennyiségben tartalmazná. Ennek megvalósításához viszont nincs elég in vivo kísérleti adat. Ezért nagyon fontos, hogy minden laboratóriumban megfelelő minőségű táptalajt használhassanak a Sumetrolim érzékenység meghatározásához, ellenőrizve a táptalaj alkalmasságát, hiszen a korrekt laboratóriumi mérések az antibiotikum választást nagy mértékben befolyásolják.
A szerzők köszönik Tóth Klára, Gaviczki Éva, Nagyváradi Frigyesné és Mórotz Imréné asszisztensek kiváló technikai munkáját. E munkát az EGIS Gyógyszegyár Rt. támogatta, a MKF 92/98. számú szerződésben foglaltak szerint.
Czirók É: Klinikai és járványügyi bakteriológia. Kézikönyv. Melania Kft. 1999
Goodman G: The pharmacological basis of therapeutics. Ninth edition, McGraw-Hill
Béládi I, Nász I: Orvosi mikrobiológia. Semmelweis Kiadó, Budapest, 1997
Bognár Cs: Szulfonamid és trimethoprim antagonisták hatása a streptococcusok Sumetrolim érzékenységére. Diplomamunka, Kertészeti és Élelmiszeripari Egyetem, Budapest, 1988.
Rubin RH, Swartz MN: Trimethoprim-sulfamethoxazole. N Engl J Med 1980; 303: 426
Jawetz, Melnick, Adelberg's Medical Microbiology. Twenty-first edition, Appleton and Lange, 1998
Hitchings GH: Inhibition of folate metabolism in chemotherapy, The origins and uses of co-trimoxazole. Springer-Verlag, 1983
Koch AE, Burchall JJ: Reversal of the antimicrobial activity of trimethopr~m by thimidine in commercially prepared media Appl. Microbiol 1971; 22: 812
Huovinen P: Increases in rates of resistance to trimethoprim Rewiew Clin Infect Dis 1997; 24: Suppl
Traub WH, Geipel U, Leonhard B: Antibiotic susceptibility testing (agar disc diffusion and agar dilution) of clinical isolates of Enterococcus faecalis and is E. faecium: comparison of Mueller-Hinton, Iso-Sensitest, and WilkinsChalgren agar media. Chemotherapy 1998; 44: 217
Giger O, Mortensen JE, Clark RB, et al.: Comparison of five different susceptibility test methods for detecting antimicrobial agent resistance among Haemophilus influenzae isolates Diagn Microbiol Infect Dis 1996; 24: 145
Jesudason MV, Pandian R, Mukundan U, et al.: False resistance of salmonellae to trimethoprim-sulphamethoxazole in disc diffusion method Indian J Med Res 1991; 93: 356
Murray PR, Zeitinger JR: Evaluation of Mueller-Hinton agar for disk diffusion susceptibility tests J Clin Microbiol 1983; 18: 1269
Maskell R, Okubadejo OA, Payne RH: Thymine-requiring bacteria associated with co-trimoxazole therapy Lancet 1976; 1: 834
* Levélcím: Dr. Latkóczy
Krisztina:
egyetemi orvosgyakornok SOTE
Mikrobiológiai Intézet
1445 Budapest, Pf. 370 Tel/Fax: 210-29-59
Email: latkri@net.sote.hu