The aim of our work was to develop a method to determine the H+/K+-ATPase activity of human gastric biopsy samples.
Our method is based on the phosphatase activity and the K+-inducable property of the enzyme. K+-inducable pNPPase activity was determined from homogenated corpus and antrum biopsy samples. H+/K+-ase activity was calculated as the difference between the corpus and antrum K+-inducable pNPPase activities.
Quality control measurements were done during 20 successive days from pooled homogenates. The total, between-day, and between-run, within-day and within-run coefficients of variations were between 10% and 16%.
After the reproducibility tests the reference values were determined from 102 corpus and antrum biopsy samples without histological abnormality; then the enzyme activities of 250 patients suffering from gastritis and/or atrophy.
The healthy reference range of K+-inducable pNPPase activity in the corpus was 95.8 (95% CI: 83.4-108.2) mU/mg protein; in the antrum it was 28.3 (21.6-35.0) mU/mg protein. The calculated H+/K+-ATPase activity was 67.2 (56.9-77.5) mU/mg protein. The measured activities were independent of age and gender. The K+-inducable pNPPase activity in the corpus was 3-5 times of the antrum (p<<0.001), independently of histological alterations. The K+-inducable pNPPase activities were the highest in the corpus without any histological abnormalities. The enzyme activity decreased proportionally with the severity of the gastritis. The Na+/K+-ATPase enzyme activities were also determined as a reference. The values of the Na+/K+-ATPase activity were stable, independently of the underlying pathology and the anatomical site of the biopsy. In moderate gastritis a correlation was observed between H. pylori infection and corpus K+-inducable pNPPase activities. Summarising our results we concluded that our method might be a valuable tool to gather data about the functional acid producing capability of human gastric mucosa.
Key words: K+-inducable pNPPase, H+/K+-ATPase, acid production, parietal cell, gastritis, H. pylori, atrophy
A gyomor savtermelésében központi szerepet játszik a nyálkahártya fedősejtjeinek apikális felszínén elhelyezkedő H+/K+-ATPáz enzim (EC 3.6.1.36). A fedősejtek megtalálhatók a gyomor fundusában és a corpusban, de nincsenek jelen az antrumban. Az enzim ATP energiájának felhasználásával, magnézium jelenlétében H+-t pumpál ki a sejtmembránon keresztül miközben K+-t juttat a sejtbe. Működésének eredményeként a gyomor lumenében megnő a H+- koncentráció és a gyomornedv pH-ja csökken (1,2).
Pentagasztrinnal stimulált savtermelési vizsgálatok bizonyították, hogy a savtermelés változik gastritisben, ulcus pepticumban, és gastricus atrófiában (3,4,5).
Annak ellenére, hogy a savtermelés vizsgálatára használt módszerek széles körben elterjedtek a klinikai használatban, kivitelezésük gyakran nehézséget okoz. Emellett ezek az eljárások csak a gyomornedvről adnak információt, melyet befolyásolhat egyéb alkalikus vegyhatású tényezők jelenléte (6), a savtermelésért felelős nyálkahártya területe és a fedősejtek száma (7,8). Közvetlenül a gyomor nyálkahártya H+/K+-ATPáz aktivitásra vonatkozó humán adat eddig nem állt rendelkezésre.
Ezért kifejlesztettünk egy módszert a H+/K+-ATPáz aktivitására utaló, K+-mal indukálható pNPPáz paranitrofenil/foszfát (K+-ind. pNPPáz) meghatározására humán gyomornyálkahártya biopsziák homogenizátumában (9), majd meghatároztuk a nem- és a korfüggő egészséges referencia értékeket.
250 esetben olyan betegeknél is meghatároztuk a K+-ind. pNPPáz aktivitását gyomor nyálkahártya biopsziákban, ahol a szövettani vizsgálat patológiás eltéréseket mutatott ki.
Betegek és minta - A SE ÁOK II. Belgyógyászati Klinika és a SE ÁOK I.Gyermekklinikájának Gasztroenterológiai Szakrendelésén megjelent 352 beteget vontunk be a vizsgálatba. (A betegeknél diagnosztikus célból történt felső emésztőrendszeri endoszkópia.)
A megfelelő tájékoztatás és a betegek hozzájárulása után a gyomorbiopsziás mintákat a gyomor corpus és az antrum nyálkahártyájából vettük. Egyidejűleg szövettani vizsgálatra is történt mintavétel.
A korra és a nemre vonatkozó egészséges referencia értékek meghatározására 102 egyénnél (kor 1-87 év között, 54 nő, 48 férfi), akiknél a párhuzamosan végzett szövettani vizsgálat nem mutatott eltérést, a gyomor nyálkahártyájában mértük meg a H+/K+-ATPáz enzim aktivitását. 250 esetben a szövettani vizsgálat patológiás eltérést mutatott ki. Ezeket a betegeket a kórfolyamatuk jellegét és súlyosságát figyelembe véve, Sydney klasszifikáció szerint osztottuk 5 csoportba a szövettani eredmények alapján (13). I. csoport: fiziológiás nyálkahártya szövettan (n=102, átlagos életkor: 36.4 év, tartomány: 1-87 év), II a. csoport: I. stádiumú gastritis H. pylori fertőzés nélkül (n=73, átlagos életkor: 50.0 év, tartomány: 14-81 év), II b. csoport: I. stádiumú gastritis H.pylori fertőzéssel (n=27, átlagos életkor: 51.4 év, tartomány: 20 - 78 év); III a. csoport: II. stádiumú gastritis H.pylori fertőzés nélkül (n=26, átlagos életkor: 55.4 év, tartomány: 16-83 év); III b. csoport: II. stádiumú gastritis I. stádiumú H. pylori fertőzéssel (n=21, átlagos életkor: 59.4 év, tartomány: 25-79 év); III c. csoport: II. stádiumú gastritis II. stádiumú H. pylori fertőzéssel (n=47, átlagos életkor: 54.0 év, tartomány: 31-76 év); III. d. csoport: II. stádiumú gastritis III. stádiumú H. pylori fertőzéssel (n=11, átlagos életkor: 56.4 év, tartomány: 35-77 év); IV b. csoport: III. stádiumú gastritis I - III. stádiumú H. pylori fertőzéssel (n=23, átlagos életkor: 53.6 év,tartomány: 32-69 év); V.a. csoport: I-III. stádiumú mucosa atrófia H. pylori fertőzés nélkül (n=17, átlagos életkor: 64.5 év, tartomány: 43-82 év); V.b. csoport: I-III. stádiumú mucosa atrófia H. pylori fertőzéssel (n=5, átlagos életkor: 48.2, tartomány: 26-78 év).
A corpus nyálkahártya biopsziákban a K+-ind. pNPPáz aktivitást az összes esetben (n=352) meghatároztuk; a K+-ind. pNPPáz aktivitást az antrum mintákban 309 esetben, a Na+/K+-ATPáz aktivitást 247 corpus és 245 antrum mintában mértük meg.
Mintafeldolgozás - Az enzimaktivitás vizsgálatához vett biopsziás mintákat azonnal -80°C-ra fagyasztottuk és a feldolgozásig ezen a hőmérsékleten tároltuk. A mérések előtt, a felolvasztást követően jégfürdőben, 10 mmol/I TRIS-HCl (pH 7,4), 1 mmol/l EDTA koncentrációjú és 10% Sigma protease inhibitor cocktail-t (P2714) tartalmazó elegyben homogenizáltuk a mintákat.
A mérésekre - a reprodukálhatósági vizsgálatok kivételével - a mintavételt követően 2 napon belül sor került.
H+/K+-ATPáz aktivitás mérés - Az enzimaktivitásra a H+/K+-ATPáz K+-mal indukálható foszfatáz aktivitása alapján következtettünk.
A méréseket Hitachi 704 klinikai kémiai automatán végeztük. 380
A K+-ind. pNPPáz aktivitás megállapításához a K+ mentes közegben mért pNPPáz értékeket kivontuk a K+-t tartalmazó közegben mért értékekből minden egyes mintánál.
A H+/K+-ATPáz aktivitást a corpusban és az antrumban mért K+-ind. pNPPáz aktivitás különbségeként adtuk meg. Egy milliegység (mU) H+/K+-ATPáz aktivitás megfelel 1 perc alatt 1 nmol-nyi pNPP-bontásnak.
Linearitás vizsgálat - Több corpus minta homogenizátumából 0.25, 0.5, 1, 1.5, és 3 g/l-es fehérje koncentrációjú mintákat hígítottunk ki. A K+-ind. pNPPáz aktivitást meghatároztuk a különböző fehérjekoncentrációk függvényében, ill. desztillált víz hozzáadására.
Reprodukálhatósági vizsgálat - Megfelelő számú alacsony (öt ismétlés átlagos aktivitása: 8.5 mU), közepes (18.5 mU) és nagy (262.9 mU) aktivitású homogenizátumot mértünk ki. Két mintából, mintánként kétszer végeztünk naponta kétszer K+-ind.<~>pNPPáz meghatározást húsz napon keresztül. (11). Az azonos mintáknál a mérések között eltelt idő 10 és 20 perc között volt.
Na+/K+-ATPáz aktivitás mérés - Annak eldöntésére, hogy a kapott aktivitás-értékekben megfigyelt változások mennyire specifikusak a K+-mal indukálható pNPPáz aktivitásra, referencia-enzimként meghatároztuk a homogenizátumok Na+/K+-ATPáz aktivitását is (12). 20ml homogenizátumot mértünk hozzá 380ml reakcióelegyhez (végkoncentráció 100 mmol/l Na/Cl, 20 mmol/l KCI, 2,5 mmol/l MgCl2, 0,5 mmol/l EGTA, 50 mmol/l TrisHCI (pH 7,4), 1 mmol/l ATP, 1 mmol/l phosphoenolpyruvate, 0,16 mmol/l NADH, 20U pyruvate kinase, 20U lactate dehydrogenase (Sigma St. Louis, USA)). A NADH oxidációt 10 percig 340 nm-es hullámhosszon monitorizáltuk. A homogenizátum Na+/K+-ATPáz aktivitását 1 mmol/l ouabain hiányában ill. jelenlétében, a NADH bomlás sebessége közötti különbség alapján határoztuk meg. Egy egység Na+/K+-ATPase aktivitás 1 mmol NADH oxidációjának felet meg percenként.
Fehérje-meghatározás - Az enzim aktivitásokat a homogenizátumok fehérje tartalmára vonatkoztattuk. A minták fehérje koncentrációját pirogallol-vörös módszerrel határoztuk meg (10) szarvasmarha szérumalbumint használva standardként.
Statisztikai értékelés - Az egyes betegek gyomor corpus és antrum mintáiban mért H+/K+-ATPáz és Na+/K+-ATPáz aktivitásokat egymintás t próbával, az egyes csoportokban mért H+/K+-ATPáz és Na+/K+-ATPáz aktivitásokat ANOVA-val hasonlítottuk össze. Az enzimaktivitások és a H. pylori fertőzés súlyossága közötti összefüggést lineáris regresszióval vizsgáltuk. Az adatainkat átlag ± átlag hibája (SEM) formában adtuk meg.
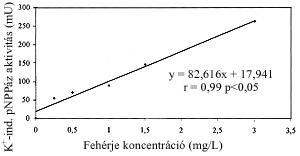
A 0-300 mU között a K+-mal indukálható pNPP hidrolizáció sebessége a mérés 200. és 600. másodperce között lineáris volt (r=0.99). Az aktivitás értékek egyenes arányban változtak a fehérjekoncentrációkkal (y=82.6x+17.9, r=0.99, p<0.001) (1.ábra).

1. ábra
K+-mal indukálható pNPPáz enzimaktivitás a fehérje koncentráció függvényében
A méréshatár (desztillált víz jelenlétében bekövetkező spontán pNPP defoszforiláció átlaga +3 SD) 1.8 mU volt.
Az összes, az egyes napok közötti, az egyes mérések közötti, az egy adott napon belüli és az egy adott mérésen belüli variációs koefficiensek értékeit az 1. táblázat mutatja. A mért variációs koefficiens értékek 10 és 16 % közé estek.
|
1. táblázat Variációs együtthatók (CV)
|
Annak ellenére, hogy a homogenizátumokat -80°C-on tároltuk, az aktivitások csökkentek a reprodukálhatósági vizsgálat 20 napja során (p<0.05).
A corpusban a K+-mal indukálható pNPPáz aktivitás egészséges referencia értéke 95.8 (95% CI: 83.4-108.2) mU/mg fehérje; az antrumban 28.3 (21.6-35.0) mU/mg fehérje volt. A számított H+/K+-ATPáz aktivitás értékei 67.2 (56.9-77.5) mU/mg fehérje voltak.
A mért aktivitásértékek nemtől és kortól függetlenek voltak.
A Sydney klasszifikáció alapján elkülönített csoportokban mért értékeket a 2. táblázat tartalmazza.
|
2. táblázat A K+-mal indukálható pNPPáz és a Na+/K+-ATPáz enzimaktivitás értékek a különböző súlyosságú gastritisben és H.Pylori fertőzésben szenvedő betegek csoportjaiban
Rövidítések: gr: stádium, HP-: Heliobacter negatív, HP+: Heliobacter pylori pozitív |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A szövettani eredmények az esetek többségében különböztek a corpusban és az antrumban, ezért ezekben az esetekben nem lehetett közvetlenül meghatározni a H+/K+-ATPáz aktivitást. A K+-mal indukálható pNPPáz aktivitás a corpusban 3-5-szerese volt az antrumban mértnek (p<0.001) függetlenül a gyomor-nyálkahártya aktuális állapotától. A legmagasabb K+-ind. pNPPáz aktivitást a szövettani elváltozást nem mutató corpus biopsziákban mértünk. A gastritis súlyosságával egyenes arányú csökkenés volt megfigyelhető a K+-ind. pNPPáz esetében. (2. a és b ábra). Középsúlyos gastritisben pozitív korreláció volt megfigyelhető a H. pylori fertőzés és a K+-ind. pNPPáz aktivitás között (p<0.05) (3. ábra). A 20Na+/K+-ATPáz enzim aktivitása nem különbözött az corpusból és az antrumból származó mintákban. Egyedül a IV-es csoportban volt megfigyelhető eltérés a Na+/K+-ATPáz enzim aktivitásában.
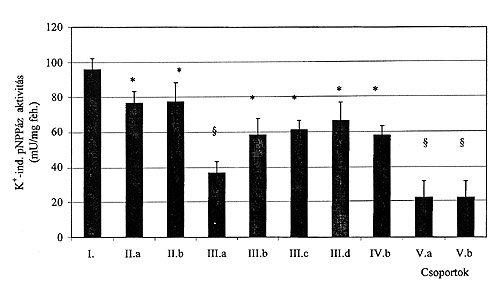
2.a. ábra
K+-mal indukálható pNPPáz enzimaktivitás corpusban
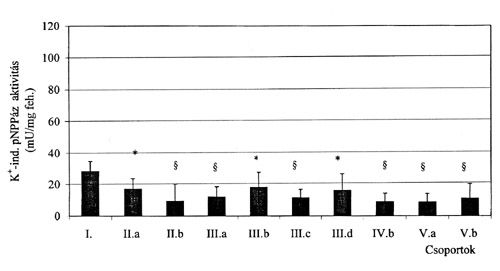
2.b. ábra
K+-mal indukálható pNPPáz enzimaktivitás antrumban
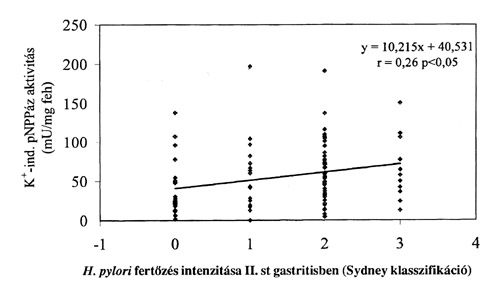
3. ábra
II. stádiumú gastritisben a K+-mal indukálható pNPPáz enzimaktivitás értékei és a H. pylori fertőzés értékeinek összefüggése
Annak ellenére, hogy a sósav termelésében a H+/K+-ATPáz működése központi szerepet játszik, eddig nem állt rendelkezésre olyan vizsgálómódszer, mely alkalmas lett volna közvetlenül a gyomor nyálkahártyájából meghatározni ezen enzim aktivitását. A savtermelést és a gyomor pH-ját mérő módszerek nem tükrözik az enzim tényleges aktivitását a gyomor nyálkahártyájában, mivel az általuk kapott eredményeket befolyásolhatják a gyomornedvben előforduló alkalizáló tényezők és a parietalis sejtek tömege (6).
A H+/K+-ATPáz K+-mal indukálható pNPPáz tulajdonsága alapján mérhető az enzim aktuális működése. (2, 14-15) Ennek alapján dolgoztunk ki egy automatizált vizsgálómódszert, mellyel meghatározhatóvá vált az enzim aktivitására utaló K+-ind. pNPPáz mérése humán gyomorbiopsziás mintákban.
A minőségvizsgálat céljából végzett linearitási és reprodukálhatósági vizsgálatok eredményei alapján módszerünk megfelel a klinikai laboratóriumi minőségi követelményeknek.
Kiemelt figyelmet kell azonban fordítani a minták tárolására, mert ez jelentősen befolyásolhatja az enzimaktivitást. Az enzimaktivitások már 10 percen belül is csökkenhetnek. Emellett a minták -80°C fokon való tárolása is befolyásolhatja az eredményeket.
A H+/K+-ATPáz aktivitás nem mutatott változást 6 és 87 év között. Ez megfelel azoknak az eredményeknek, melyek az életkor hatását vizsgálták egészséges egyénekben a savtermelésre (5, 16, 17). A savtermelést meghatározó módszerekkel az idősekben észlelt hipoaciditás így nem magyarázható csökkenő H+/K+-ATPáz enzim aktivitás értékekkel. Feltételezhető, hogy az életkor előre haladtával a savtermelést a nyálkahártyát érintő kóros folyamatok károsítják, így az atrófia, amely gyakoribb az idős betegeknél. A nem ugyancsak nem volt befolyással a H+/K+-ATPáz aktivitásra, amely megegyezik azokkal az adatokkal, melyeket Kekki és mtsai közöltek (7,8).
Az antrumban a szomatosztatint termelő sejtek pusztításán keresztül a gasztrin termelődést gátló szabályozás gyengül.
Ezért az enzim aktivitásokat a mintavételt és a homogenizálást követően minél hamarabb meg kell határozni.
Bár a K+-ind. pNPPáz aktivitást a parietalis sejtek anatómiai elhelyezkedésnek megfelelően elsősorban csak a corpusban lehetett mérni, antrumban is mérhető volt az enzimaktivitás. Ennek hátterében feltételezhetően egyéb foszfatázok jelenléte állhat. Mivel a corpus és az antrum nyálkahártyája között a legfőbb különbség a parietalis sejtek jelenléte, melyek a corpusban a sósavtermelésért felelősek, ezért a corpusban és az antrumban K+-ind. pNPPáz aktivitás közötti különbség tükrözheti a corpus H+/K+-ATPáz aktivitását.
Azokban az esetekben, ahol különböző súlyosságú patológiai folyamatok befolyásolják az antrumot és a corpust az alap-K+-ind. pNPPáz aktivitás különböző mértékben változhat; a H+/K+-ATPáz aktivitását ilyen esetekben nem lehet az antrum és a corpus pNPPáz aktivitások különbsége alapján kiszámolni. Ilyenkor az egyes régiókban mért K+-ind. pNPPáz aktivitás utalhat csak az ottani H+/K+-ATPáz aktivitásra.
Korábbi megfigyelések szerint a H. pylori kettős hatást fejt ki a gyomor nyálkahártya savtermelésére. (18-22) Az esetek többségében a baktérium kezdetben antralisan telepedik meg. Emellett a baktérium ureáz termelő tulajdonsága miatt emelkedik a pH az antrumban.(18-19). Ennek következtében emelkedik a gasztrin termelés, ami a kevésbé károsodott corpusban fokozott savtermelést eredményezhet. Beil és társai szerint a H+/K+-ATPáz molekulaszerkezetét is megváltoztathatja a H. pylori fertőzés, mely ugyancsak fokozza az enzim aktivitását(23).
Másrészről a H. pylori azáltal, hogy az általa okozott krónikus gyulladás károsítja a corpusban a savtermelő nyálkahártyát és a későbbiekben emiatt atrofia is kialakulhat, végül is csökkenti a savtermelést.
Ez utóbbival magyarázható az eredményeink közül az az összefüggés, hogy krónikus gastritisben a nyálkahártya gyulladás súlyosságának megfelelően fordított arányban változik a K+-mal indukálható pNPPáz aktivitás (IIa, IIIa, IV. csoport). A corpusban a K+-ind. pNPPáz aktivitás jelezheti az alacsonyabb H+/K+-ATPáz aktivitást és az alacsonyabb savelválasztást (4). A gyomor nyálkahártyájának atrófiáját, a savtermelő sejtek nagyarányú pusztulását egyidejűleg a K+-ind. pNPPáz aktivitás csökkenése is kíséri.
Vizsgálataink során megfigyelhető volt, hogy a H.pylori fertőzés jelenléte mérsékli a K+-ind. pNPPáz aktivitás csökkenését közepesen súlyos gastritisben (IIIa-IIId csoport). Az azonos fokú gyulladások esetében a H. pylori fertőzés súlyossága viszont egyenesen arányos volt a K+-ind. pNPPáz aktivitással. Ez a megfigyelés utalhat a baktérium által kiváltott aktiváló hatásra, mely a K+-ind. pNPPáz aktivitás mérsékeltebb csökkenésében nyilvánul meg. Ez az összefüggés csak a közepesen súlyos gastritisek esetén volt megfigyelhető. A kapcsolat nem volt kimutatható enyhe gyulladásban, ahol a gyomor nyálkahártya csak mérsékelten károsodott, ill. súlyos gastritisben és atrofiában sem, ahol a savtermelő nyálkahártya gyakorlatilag hiányzik (Va-Vb csoport).
A K+-ind. pNPPáz aktivitásra jellemző összefüggések specifikusnak tűnnek, mivel a Na+/K+ATPáz enzim esetében ezek nem voltak kimutathatók. Az antrumban és a corpusban mért Na+/K+-ATPáz aktivitások között nem volt eltérés és azokat a patológiás folyamatok jelenléte sem befolyásolta.
Eredményeinket összefoglalva megállapítottuk, hogy módszerünk értékes segítséget nyújthat a humán gyomor funkcionális állapotának, savtermelő képességének a vizsgálatában. További vizsgálatok szükségesek annak eldöntésére, hogy gyógyszeres kezelés (savgátló szer) ill. patológiás folyamatok monitorizálására mennyire használható ill. az ezzel kapott eredmények mennyire állnak összhangban az egyéb savtermelési vizsgálatok eredményeivel.
Az enzimaktivitásokat a SE ÁOK I. Gyermekklinika és a Heim Pál Kórház Központi Laboratóriuma közötti tudományos együttműködés keretében a Heim Pál Kórház Központi Laboratóriumában határoztuk meg.
A szerzők köszönetet mondanak a vizsgálat során nyújtott segítségükért a SE ÁOK II. sz. Belgyógyászati Klinika és az I.sz. Gyermekklinika Gasztroenterológiai Szakrendelésének és a Heim Pál Kórház Központi Laboratórium munkatársainak. A munkánkhoz a szükséges anyagi hátteret az OTKA T031850, F032024 kutatási keretek biztosították.
Rabon EC, Reuben MA. The gastric H+/K+-ATPase
Annu Rev Physiol 1990; 52: 321-44
Hersey S.J, Sachs G. Gastric acid secretion
Physiol Rev 1995; 75(1): 155-89
Sachs G, Meyer-Rosberg K, Scott DR, et al.: Acid secretion and Helicobacter pylori Digestion 1997; 58: Suppl 1:8-13
Sipponen P, Kekki M, Seppala K, et al: The relationships between chronic gastritis and gastric acid secretion Aliment Pharmacol Ther 1996; 10Suppl 1: 103-18
Katelaris PH, Seow F, Lin BP, et al.: Jones DB.Effect of age, Helicobacter pylori infection, and gastritis with atrophy on serum gastrin and gastric acid secretion in healthy men Gut 1993; 34: 1032-7.
Feldman M, Cryer B. Effects of age on gastric alkaline and nonparietal fluid secretion in humans Gerontology 1998; 44: 4:222-227.
Kekki M, Sipponen P, Siurala M. Age behaviour of gastric acid secretion in males and females with a normal antral and body mucosa Scand J Gastroenterol 1983; 18: 1009-16.
Kekki M, Samloff IM, Ihamäki T, et al.: Age- and sex-related behaviour of gastric acid secretion at the population level Scand J Gastroenterol 1982; 17: 737-43
Kocsis I, Vásárhelyi B, Tulassay Zs, és mtsai.: Determination of H+/K+ATPase activity in human gastric biopsy samples Clin Chem Lab Med 2000; 38(8) 743-45
Watanabe N, Kamei S, Ohkubo A, et al.: Urinary protein as measured with a pyrogallol red-molybdate complex, manually and in a Hitachi 726 automated analyzer Clin Chem 1986; 32: 1551-4.
NCCLS. Tentative Guideline EPS-T. User elevation ofprecision performance of clinical chemistry devices. Villanova PA: National Committee forClinical Laboratory Standards, June 1984.
Vásárhelyi B, Szabó T, Vér Á, és mtsai.: Application of themeasurement of Na/KATPase activity on a Hitachi 704 automatic analyzer Clin Chem 1997; 43: 1986-1987
Price AB. The Sydney system: histological division J Gastroenterol Hepatol 1991; 6: 20922
Nishioka K, Nagao T, Urishidani T. Correlation between acid secretion and proton pump activity during inhibition by the proton pump inhibitor someprazole and pantoprazole Biochem Pharmacol 1999; 58: 1349-59
Ljungstrom M, Mardh S. Kinetics of the acid pump in the stomach. Proton transport and hydrolysis of ATP and p-nitrophenyl phosphate by the gastric H,K-ATPase J Biol Chem 1985; 260: 5440-4
Pilotto A. Gastric ulcer in the elderly,
Ital J Gastroenterol 1994; 26: Suppl 1:10-5
Collen MJ, Abdulian JD, Chen YK. Age does not affect basal gastric acid secretion in normal subjects or in patients with acid-peptic disease Am J Gastroenterol 1994; 89: 712-6
Graham DY, Opekun A, Lew GM, et al.: Helicobacter pylori-associated exaggerated gastrin release in duodenal ulcer patients. The effect of bombesin infusion and urea ingestion Gastroenterology 1991; 100: 1571-75
Calam J, Gibbons A, Healey ZV, et al.: How does Helicobacter pylori cause mucosal damage? Its effect on acid and gastrin physiology Gastroenterology 1997; 113: S43-S50
Kuipers EJ, Uyterlinde AM, et al.: Long-term sequelae of Helicobacter pylori gastritis Lancet 1995; 345: 1525-8
Keith WT, George FT. Pathogenesis of Helicobacter pylori infection Curr Opinion in Gastroenterol 1999; 15: 66-71
Hurlimann S, Dur S, Schab P, at al.: Effects of Helicobacter pylori on gastritis, pentagastrin-stimulated gastric acid secretion, and meal stimulated plasma gastrin release in the absence of pepticulcer disease Am J Gastroenterol 1998; 93: 1277-85
Beil W, Sewing KF. Interaction between Helicobacter pylori, gastric H+/K+-ATPase and proton pump inhibitors Arch Pharmacol 1998; 358: S3, R767
* Levélcím: Kocsis István
I. sz. Gyermekklinika, Semmelweis Egyetem ÁOK
1083 Bókay J. u. 53 Budapest
Tel: 06-1-3142858 Fax: 06-1-313 8212
E-mail: kopist@gyer1.sote.hu